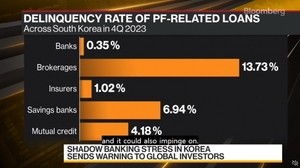
수젠텍이 국내 임상 실시 기관인 대학병원 임상시험심사위원회(IRB)승인을 획득해 국내 출시를 본격화한다. 이번 승인은 신속진단키트의 국내 사용을 위한 임상시험으로 올해 중으로 국내에서도 항체 신속진단키트가 사용될 것으로 예상된다.
수젠텍은 코로나19 항체 신속진단키트 'SGTi-flex COVID-19'제품이 국내 임상 실시기관인 대학병원으로부터 임상시험심사위원회(IRB)의 승인을 획득하였으며 임상시험을 진행하고 있다고 23일 밝혔다. 수젠텍은 임상과 관련해 지난 8월 한국 식품의약품안전처(식약처)의 임상 사전승인계획서(IND) 승인을 받은 바 있다.
수젠텍은 이번에 진행되고 있는 임상 결과를 기반으로 한국 식약처에 제조허가를 신청할 계획이다. 관련 승인은 올 하반기 중으로 나올 가능성이 높아 국내 최초로 미국 식품의약처(FDA)의 긴급사용승인(EUA)을 받은 코로나19 항체 신속진단키트가 국내에서도 사용이 가능할 전망이다.
이미 미국과 유럽을 비롯한 해외 각국에서는 항체 진단을 분자진단(PCR)과 병행 사용하고 있어 확진자 판별뿐 아니라 감염 이력과 완치자의 일상생활 복귀 여부를 판단하는 데 활용하고 있다. 우리나라에서는 방역 정책상 코로나19 진단에 분자진단(PCR)방식만 사용하고 있지만, 식약처는 지난 6월 코로나19 진단기기에 대한 정식 사용승인 가이드라인을 마련해 신속 허가를 진행하고 있어 임상 결과가 나올 경우 빠른 시일 내 사용승인이 가능하다.
수젠텍 관계자는 "코로나19가 장기화되는 상황에서 일선 병·의원 및 의료기관 등에서 감염의심자 선별을 위한 항체진단 도입이 꾸준히 제기되고 있으며 무증상 감염자 수 증가, 지역감염 확산 우려 등 항체진단을 적용할 필요성이 높아진 상황"이라며 "수젠텍은 이번 진행하는 임상시험을 통해 한국 식약처의 정식 사용승인을 받아 향후 국내 병·의원 및 의료기관 등에서 항체 신속진단키트를 활용할 수 있기를 기대한다"고 말했다
뉴스타운
뉴스타운TV 구독 및 시청료 후원하기
뉴스타운TV
























![[특별대담] 제22대 국회의원 선거 자유민주당 인천 서구병 이진기 예비후보](/news/photo/202403/600022_545770_3853.jpg)






![[긴급시국분석] 북한의 내년 4월 총선 전후 기습남침과 좌파들의 내란 및 전민봉기 철저히 대비하라!](/news/thumbnail/202312/592978_536686_4219_v150.jpg)